Бромистый водород — Hydrogen bromide
Бромоводород представляет собой гетероядерное двухатомное молекулярное соединение формулы HBr и галогенид водорода, состоящий из водорода и брома. В чистом виде это бесцветный газ.
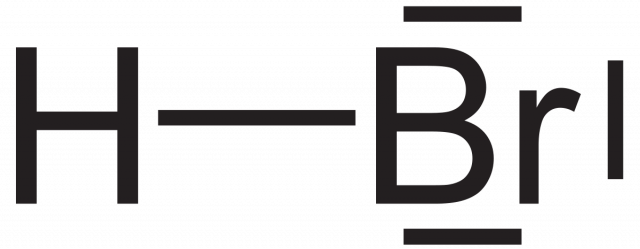
Бромистый водород хорошо растворяется в воде, и образуется бромистоводородная кислота, которая при комнатной температуре насыщается 68,85% HBr. Водные растворы, которые содержат 47,6 мас.% HBr, образуют азеотропную смесь с постоянным кипением, которая кипит при 124,3 ° C. При кипячении менее концентрированных растворов выделяется H 2 O до тех пор, пока не будет получен постоянный состав.
Безводные и водные растворы HBr являются обычными реагентами при получении бромидных соединений.
Бромистый водород и бромистоводородная кислота являются важными агентами в производстве неорганических и органических соединений брома. Радикальное присоединение HBr к алкенам дает алкилбромиды:
RCH = CH 2 + HBr → R — CHBr — CH 3
Эти алкилирующие агенты являются предшественниками производных жирных аминов. Подобное добавление свободных радикалов аллилхлорида и стирола дает 1-бром-3-хлорпропан и фенилэтилбромид соответственно.
Бромистый водород реагирует с дихлорметаном с образованием бромхлорметана и дибромметана, последовательно:
HBr + CH 2 Cl 2 → HCl + CH 2 BrCl
HBr + CH 2 BrCl → HCl + CH 2 Br 2
Аллилбромид получают обработкой аллилового спирта HBr:
CH 2 = CHCH 2 OH + HBr → CH 2 = CHCH 2 Br + H 2 O
Возможные применения
HBr разработан для использования в проточных батареях.
Промышленная подготовка
Бромистый водород (наряду с бромистоводородной кислотой) производится комбинацией водорода и брома при температурах от 200 до 400 ° C. Реакция обычно катализируется платиной или асбестом.
Безводный бромистого водорода также может быть получен в небольших масштабах путем термолиза бромистого трифенилфосфони с обратным холодильником в ксилоле.
Бромистый водород, полученный указанными выше способами, может быть загрязнен Br 2, который можно удалить, пропустив газ через раствор фенола при комнатной температуре в четыреххлористом углероде или другом подходящем растворителе (с получением 2,4,6-трибромфенола и образованием большего количества HBr в процессе) или через медную стружку или медную сетку при высокой температуре.
Безопасность
HBr вызывает сильное разъедание и раздражение при вдыхании, будьте внимательны.






